第一套合理的离液膜转运体设计原理
将不可渗透的分子内化到细胞中一直是药物开发中的难题,特别是对于无法扩散穿过细胞膜的水溶性生物活性化合物。为了克服这个问题,人们设计了各种人工转运体,包括聚合物、脂质和阳离子渗透肽。到目前为止,这些载体主要依靠两亲性作为使它们能够穿过脂质双层的关键特性。然而,这些转运体经常会因为两亲分子的固有特性而受到限制。例如,它们类似洗涤剂的行为会导致细胞膜损伤,从而导致毒性问题,而且它们的聚集倾向可能会限制它们在较高浓度下的效用。
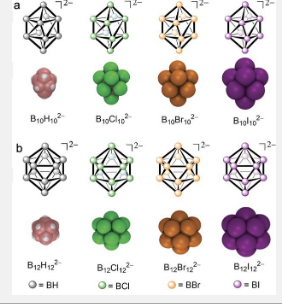
最近,得益于南加州大学生物化学和分子材料研究中心 (CiQUS, USC) 的 Javier Montenegro 教授团队与德国不来梅建筑大学 Werner M. Nau 教授团队的合作,一种利用亲水分子与超离液硼簇的超分子结合,将亲水分子运送到膜外的新方法应运而生。与两亲分子的传统机制不同,全卤化封闭十二硼酸盐促进的运输是通过离液效应而不是两亲活化来实现的。这种离液膜运输表现出焓驱动的特征,不同于经典疏水效应中观察到的特征,后者归因于脱水效应和分散相互作用。
南加州大学 CiQUS、德国不来梅建筑大学和捷克科学院(捷克共和国 Řež)的研究人员最近在《应用化学国际版》上发表了一项 研究,该研究推进了对硼簇载体结构特征的理解,并建立了第一套合理的离液膜转运体设计原则。事实上,这种新型簇载体的运输效率取决于它们对膜和货物的亲和力之间的微妙平衡,这种平衡随它们的离液性而变化。然而,定义离液传输的结构-活性参数仍有待阐明。这项新发表的研究通过将卤素组成与硼核尺寸分离来研究离液传输的调节。为此,我们考虑了两组球状硼团簇:十硼酸盐 (B10X102−) 和十二硼酸盐 (B12X122−) 系列,其中 X = H、Cl、Br、I。这些组的核心中硼原子的数量不同,分别为 10 和 12,因此,每个同源团簇对都具有相同类型的取代基,但具有不同的尺寸和几何形状。通过这种方式,可以将团簇大小和极化率的影响与卤素取代基本身的性质分离开来。
研究了每种簇载体对不同亲水性肽模型货物的膜溶解特性、细胞毒性和运输效率。囊泡和细胞分析表明,一般来说,高离液性、簇大小和极化率会导致与运输货物分子的亲和力常数更高,囊泡和细胞中的膜运输效率更高,但也会导致更高的膜溶解倾向和细胞毒性,这可能是由于与生物膜的相互作用太强。因此,证明了载体效用存在一个窗口,该窗口在中等簇大小时达到。
这项研究为设计和实施具有潜在膜传输能力的离液簇及其配方提供了蓝图,证明了二价硼酸盐簇载体的尺寸和极化率(而不是其化学组成)是控制离液膜传输的基本参数
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
