糖尿病 (DM) 是一种代谢性疾病,其特征是胰腺功能失调和胰岛素分泌不足。想象一下,你的胰腺是胰岛素的工厂,胰岛素是维持血糖水平的关键激素。这个工厂里有一条称为胰岛的微型装配线。当这些胰岛受损时,就像工厂里发生了一场小型灾难。装配线发生故障,无法产生足够的胰岛素。这会导致血糖调节问题,这对你的健康来说是一件大事。
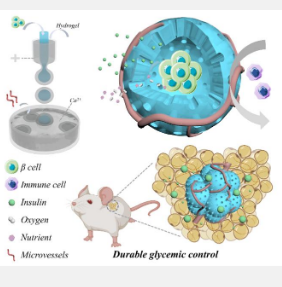
最常见的由胰岛损伤引起的疾病是 1 型糖尿病,目前尚无治愈方法。治疗主要通过注射胰岛素来控制血糖水平。然而,虽然外源性胰岛素可以暂时稳定血糖,但频繁注射会带来沉重的负担并可能导致并发症。作为替代策略的胰岛移植面临着供体短缺和长期免疫抑制的挑战。为了解决这些问题,研究人员开发了包裹胰岛/胰岛细胞的生物材料来重建胰岛功能。尽管取得了一些进展,但长期生存和持续的胰岛素分泌仍然受到免疫攻击和营养供应不足的限制。微流控技术因其精确的流体操控能力而被用于生产具有可定制结构的水凝胶。这些微胶囊促进氧气和营养物质的交换,并具有自适应结构特征,可封装其他药物来调节细胞命运。尽管如此,准确模拟天然胰岛的完整结构仍然具有挑战性。
目前重塑胰岛的方法主要集中于微胶囊的血管化。
解决方案:受天然胰岛结构的启发,中国科学家团队开发了一种基于微胶囊的仿生人工胰岛模型,该模型整合了微血管网络,并利用微流控高压电喷雾技术实现血糖水平的精细调节。
未来展望:本次实验结果为血管化微胶囊作为仿生人工胰岛模型的前景提供了有力支持,凸显了其在糖尿病治疗领域的重要价值。这一创新技术不仅为糖尿病治疗提供了新的治疗选择,也为未来的医学研究开辟了新的方向。
李玲教授提到:“我们通过微流控策略开发了一种血管化微胶囊作为仿生人工胰岛模型(v-MCs),并将其用于血糖控制。微胶囊的设计灵感来自天然胰岛的血管网络结构,具有独特的核壳结构,可以让营养物质和氧气顺利进入,同时有效保护被包裹的胰岛细胞免受宿主免疫细胞的攻击。此外,v-MCs还能对葡萄糖作出反应,进行分子交换。通过小鼠移植实验,我们发现v-MCs可以显著改善糖尿病小鼠的异常血糖水平、食物摄入量和体重,有效提高葡萄糖耐受性,显示出其作为糖尿病治疗的有效潜力。进一步的组织学分析验证了v-MCs植入体内的安全性。这些结果表明仿生人工胰岛模型在糖尿病治疗中具有重要价值,其未来在再生医学和组织工程领域的应用前景尤为广阔,值得进一步研究和期待。”
