了解癌细胞如何从原发性肿瘤扩散很重要,原因有很多,包括确定疾病本身的侵袭性。细胞进入邻近组织的细胞外基质 (ECM) 是癌症进展的重要步骤,与转移的发生直接相关。
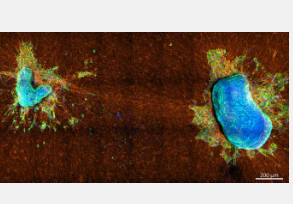
在AIP Publishing出版的APL Bioengineering杂志上,来自德国和西班牙的一组研究人员使用乳腺癌细胞系面板和来自乳腺癌和宫颈癌患者的原发性肿瘤外植体来研究两种不同的细胞收缩模式:一种产生集体组织表面张力,使细胞簇保持紧凑;另一种更具方向性的收缩模式使细胞能够将自身拉入ECM。
“我们关注两个参数,即细胞拉动 ECM 纤维并产生牵引力的能力,以及它们相互拉动从而产生高组织表面张力的能力,”作者 Eliane Blauth 说。“我们将每种特性与不同的收缩机制联系起来,并探究它们与癌细胞逃逸和肿瘤侵袭性有何关联。”
研究小组发现,侵袭性更强的细胞对 ECM 的拉力大于对自身的拉力,而非侵袭性细胞对自身的拉力大于对 ECM 的拉力,而不同的拉力行为归因于细胞内肌动蛋白细胞骨架的不同结构。侵袭性细胞主要使用肌动蛋白应力纤维(横跨细胞的粗肌动蛋白束)对周围环境产生力,而非侵袭性细胞则通过肌动蛋白皮层(细胞膜下方的薄网络)产生力。
研究表明,决定细胞逃逸潜力的不是这些收缩模式的整体大小,而是它们之间的相互作用。仅对中等侵袭性细胞进行的实验表明,这些细胞对 ECM 纤维产生的总力与非侵袭性细胞相当,但它们仍然可以脱离并侵入 ECM,而非侵袭性细胞则无法做到这一点。
“非侵袭性细胞仍然具有较高的皮质收缩性,使它们保持在一起,而中等侵袭性细胞的皮质收缩性几乎消失,”Blauth 说。“因此,尽管它们对 ECM 纤维的拉力要弱得多,但没有什么能阻止它们。”
研究团队对患者活体肿瘤外植体进行的测量证实了他们在细胞系实验中的发现。其中,在肿瘤进展过程中,皮质收缩性强的细胞数量减少。
“这进一步表明,随着肿瘤的生长,细胞相互拉动和聚集在一起的能力会变弱,从而可能增加转移风险。”
