研究团队针对菊花的CmPDS基因建立了 CRISPR/Cas9 基因编辑系统,以探索基因功能并提高育种水平。通过结合瞬时和稳定转化,他们实现了精确的基因敲除,并用与菊花白锈病 (CWR) 抗性相关的CmTGA1基因验证了该系统的有效性。这种有效、可遗传的 CRISPR/Cas9 介导的基因组编辑系统有望推动遗传研究并提高菊花的抗病性和育种能力,为培育更健壮的观赏植物铺平道路。
CRISPR/Cas 介导的基因组编辑是一种低成本、高效率的创建完全基因敲除突变体的技术。尽管 CRISPR/Cas9 已成功应用于模型植物,但不同实验中的效率差异很大,并且经常导致较高的失误率。在C. morifolium中,现有的方法如 VIGS 和 RNAi 无法实现目标基因的完全敲除。
2024 年 5 月 16 日在《观赏植物研究》上发表的一篇研究文章(DOI:10.48130/opr-0024-0012)旨在利用金门组装系统和植物瞬时 CRISPR/Cas9 编辑 (TCEP) 方法为菊花建立可靠的 CRISPR/Cas9 系统,重点通过针对 CmTGA1基因来增强抗病性。
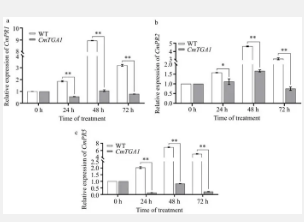
以pCBC-DT1T2质粒为模板,通过重叠PCR获得626 bp的条带,将其插入pHSE401的BsaI位点,通过冻融法将CRISPR- CmPDS敲除载体转入农杆菌菌株GV3101,RT-qPCR验证编辑效率,转基因植株中CmPDS表达量显著降低(19.1%~52%)。稳定遗传转化获得12个抗生素抗性芽,其中66.7%呈现白化表型,表明基因敲除成功。另外,构建CRISPR- CmTGA1敲除载体并验证编辑效率, CmTGA1表达量显著降低(20.1%~70.3%)。稳定转化及测序表明3株稳定转基因植株均成功进行基因编辑。CmTGA1的敲除导致对菊花锈病的抗性降低,验证了该系统在菊花抗病性研究的基因编辑中的有效性。
这项研究的首席研究员毛红宇表示:“在我们的研究中,我们首先针对菊花中的CmPDS基因进行了敲除,并通过敲除CmTGA1来验证编辑效率。CmPDS基因的敲除提供了清晰可见的转化标志。CmTGA1 的成功敲除进一步支持了我们系统的可靠性,并为对抗 CWR 疾病提供了重要信息。”
总之,这些发现证明了将瞬时和稳定转化相结合以实现菊花基因编辑的有效性,为未来遗传改良和增强观赏植物的抗病性铺平了道路。未来的研究将侧重于优化这一基因编辑平台,并探索其在培育抗病和抗逆性菊花新品种中的应用。
