实验室培育的肌肉揭示罕见肌肉疾病的奥秘
杜克大学的生物医学工程师开发出一种新技术,可以更好地了解和测试一组极为罕见的肌肉疾病的治疗方法,这种疾病被称为肢带型肌营养不良症 2B(LGMD2B)。该方法在实验室中从干细胞中培育出复杂、功能性的 3D 肌肉组织,从而创建一个可复制患者症状和治疗反应的平台。
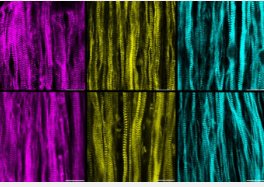
在其首项研究中,研究人员揭示了 LGMD2B 导致行动能力丧失的一些生物学机制。他们还表明,现有治疗方法的组合可能能够缓解该疾病的一些最严重症状。
研究结果于 6 月 18 日发表在《先进科学》杂志网络版上。
LGMD2B 仅影响全球每百万人中的 8 人。与更知名、更常见的杜氏肌营养不良症不同,这种疾病影响男性和女性,发病较晚(十几岁或二十出头),很少致命。然而,LGMD2B 患者的腿部和肩部会出现严重无力,通常需要终生使用轮椅。
LGMD2B 是由一种遗传性疾病引起的,它会阻止人体产生一种名为 dysferlin 的全功能蛋白质。目前尚无获批的治疗方法或治愈方法。缺乏治疗选择的部分原因是 dysferlin 具有多种功能,包括封闭肌肉膜上的孔洞、调节肌肉收缩所需的钙平衡以及控制细胞代谢。由于未知原因,受影响的肌肉最初会在肌肉纤维内积聚脂肪,然后退化并最终被脂肪细胞取代。
杜克大学生物医学工程教授内纳德·布尔萨克说:“这种现象即使对于肌肉萎缩症来说也非常罕见。为什么会发生这种情况是社区内一个亟待解决的问题。”
研究人员在试图解决这些问题时面临的挑战之一是,用于模拟 LGMD2B 的小鼠模型与患者相比表现出非常轻微的症状。患有这种疾病的小鼠仍然能够行走,而且在它们长达两年的寿命中,这种疾病直到近一年后才会出现,这使得对该疾病的研究进展极其缓慢。Dysferlin 在其他细胞类型中表达,小鼠和患者的血液中胆固醇等代谢燃料的水平也会发生变化。总之,这让 LGMD2B 研究变得复杂,因为很难评估哪些细胞类型导致了这种疾病,以及代谢变化是由于 dysferlin 本身的缺失还是全身影响造成的。
为了克服这些挑战,布尔萨克和他的研究科学家阿拉斯泰尔·霍达布库斯 (Alastair Khodabukus) 转向了他们近十年来一直在开发的工程肌肉平台。布尔萨克实验室是第一个在培养皿中培养收缩、功能性人类骨骼肌的实验室,并且从那时起一直在改进其流程,以便研究肌肉强度、新陈代谢和修复。这个系统使他们能够将研究重点放在 dysferlin 对骨骼肌的影响上,而不会受到其他细胞类型或血液代谢物谱改变的影响。
在这项研究中,研究人员首先从患有 LGMD 的患者身上提取了诱导性多能干细胞 (IPSC),这些干细胞由致力于寻找 LGMD2B 治疗方法的慈善机构 Jain Foundation 提供。实验室利用他们的肌肉生长技术将这些干细胞培养成肌肉纤维,并在六周内对它们进行了一系列测试。
就像患者体内的肌肉一样,实验室培育的肌肉也表现出各种各样的问题。
“总体而言,我们的模型重现了该疾病的许多临床表现和在真实患者身上观察到的情况,但这一切都是在培养皿中完成的,”布尔萨克说。“我们能够对该疾病的肌肉特异性方面获得新的见解。”
研究人员发现,肌肉力量的下降不是肌肉结构或大小缺陷的结果,而是肌肉处理钙质的方式不当。肌肉收缩的物理原因是肌肉细胞中储存的钙被释放并与肌肉蛋白结合。测试表明,患病的肌肉细胞的钙储备出现泄漏,导致释放的钙减少,肌肉收缩变弱。
研究人员还表明,缺乏 dysferlin 会导致肌肉细胞损伤无法修复,而无法燃烧脂肪酸来产生能量至少是造成肌肉纤维内脂肪堆积的部分原因,这一问题长期困扰着医学界。
“我们复制了患者身上看到的一些现象,并表明这不是由于体内的环境因素,而是肌肉本身的问题,”Khodabukus 说。
研究人员随后测试了两种可能治疗该疾病的候选药物的效果,这两种药物是通过小鼠模型确定的,但尚未在人体上进行测试。一种名为丹曲林的药物被认为可以阻止钙从肌肉细胞的储存器中泄漏。第二种名为瓦莫洛龙的药物最近被批准用于治疗杜氏肌营养不良症患者,尽管研究人员还不完全了解它的作用原理。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
