实体瘤的生长过程涉及其通过周围组织的扩张,周围组织通常由纤维状基质(例如胶原蛋白)组成。它的扩张取决于许多因素,例如肿瘤细胞的总数、它们的体积和硬度、它们对营养物质的获取以及它们正在发育的组织的机械特性。
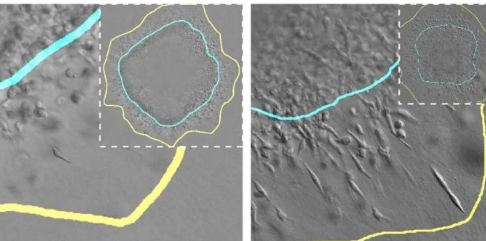
在体外实验模型的支持下,加州大学伯克利分校和约翰霍普金斯大学的研究人员开发了一种模型,可以在计算机上模拟肿瘤生长的演变,同时考虑到这些因素。
“在这个模型中,我们模拟了乳腺肿瘤细胞如何侵入周围组织,以及它们如何增殖,或多或少取决于周围组织的硬度和多孔性或细胞与其他细胞的连接有多强,”一位研究人员解释道DanielGarcíaGonzález,UC3M连续介质力学和结构分析系副教授,ERC4D-BIOMAP项目负责人。
为此,研究人员使用球体来模拟细胞在不同机械条件下在真实肿瘤中的行为。这些球体由嵌入纤维状基质中的肿瘤细胞群组成,其特征可以调节。另一位研究人员、UC3M生物工程系教授ArrateMuñoz-Barrutia解释道:“它们是非常强大的系统,越来越多地被用于研究肿瘤行为和可能的治疗方法。”
借助这些球体,研究人员能够在实验室中修改这些肿瘤的某些生物学或机械方面,并评估这些变量如何影响细胞增殖和迁移。然后,他们将这些观察结果转化为在计算模型中实现的数学方程。通过这种方式,他们能够并行测试(在计算机模拟器中和在实验室球体的实验模型中)影响这些肿瘤生长的变量。
“我们的新型多室球体系统使我们能够通过胶原蛋白密度和E-钙粘蛋白表达来控制和调节系统的生物力学特性,众所周知,这在乳腺癌进展中发挥着作用。与这个团队合作,从实验和计算的角度看到这个故事是非常令人兴奋的”,该研究的另一位作者、来自约翰·霍普金斯大学化学与生物分子工程系的DenisWirtz说道。
“虽然在实验中,增殖和侵袭通常作为两个独立的参数来测量,但我们观察到这些过程之间存在很强的耦合性。尽管无法使用传统的实验输出来分离它们,但计算模型使我们能够独立研究这些过程,并从我们系统的生物力学特性中收集见解。”JHU团队的另一位研究人员AshleighCrawford补充道。
研究人员表示,这项研究的未来应用前景广阔。DanielGarcíaGonzález表示:“如果我们知道哪些机械参数决定肿瘤的生长是更多还是更少,那么我们就可以利用这些数据来改善中长期治疗或开发新药。”ArrateMuñoz-Barrutia补充道:“我们认为这些研究为技术开发打开了大门,使我们能够表征肿瘤的机制,从而为癌症治疗的选择添加相关信息。”
科学家团队还强调了多学科研究在这种情况下的重要性,因为从计算和数学到纯粹的生物学领域都做出了贡献。
该研究的另一位作者、博士克拉拉·戈麦斯·克鲁兹(ClaraGómezCruz)表示:“我在UC3M接受的生物医学工程师培训使我能够在这项研究的各个部分进行合作,并在使用不同术语的学科之间建立沟通的桥梁”UC3M连续介质力学和结构分析系的学生。
